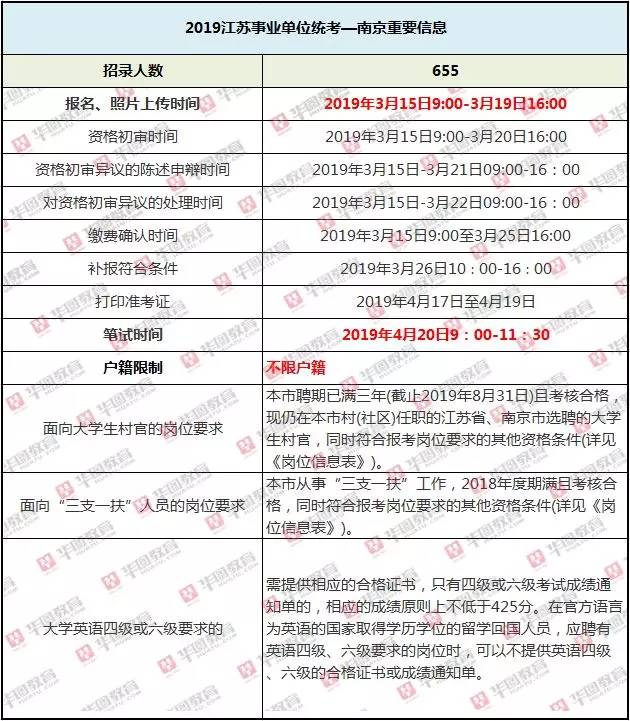
日前,Travere Therapeutics宣布,自愿暂停其候选药物pegtibatinase的3期研究HARMONY的患者入组。该公司预计,最早要到2026年才能重新恢复。
该消息发布后,Travere公司股价下跌6.85%,至14.01美元/股。同时,H.C. Wainwright将该公司的股票目标价从之前的23.00美元调整至18.00美元。
但似乎,3期临床的暂停并不是什么坏事。
研究暂停原因
根据Travere公司披露,3期研究HARMONY的暂停是因为在对pegtibatinase进行放大生产工艺的过程中,未达到所需的原料药特征。因此决定暂停患者招募,直到有更多的材料可用。
Travere公司表示,暂停患者入组,能够使其更好的解决pegtibatinase生产规模扩大中的工艺改进问题,以支持商业规模生产以及HARMONY研究的患者全面入组。
3期研究HARMONY的暂停,与pegtibatinase的安全性或有效性无关。
目前已经入组的患者不受影响,将继续按照计划进行pegtibatinase给药。
推迟两年
Pegtibatinase是一款经聚乙二醇化修饰的重组人CBS酶替代疗法,曾被认为有潜力成为治疗经典型高胱氨酸尿症(HCU)的首款疾病修正治疗(DMT)药物。Pegtibatinase由Travere公司于2020年收购Orphan Technologies获得。
Pegtibatinase于2023年第四季度推进3期临床,HARMONY研究在2023年12月进行患者招募。Travere公司曾预计HARMONY的研究将在2026年获得。
但是由于生产放大的原因,临床暂停两年,那该研究的数据也将推迟两年,意味着潜在的商业化进程也要推迟两年。
好像不是什么坏事
尽管Pegtibatinase在生产扩大中遇到挑战,暂停了3期研究,但对于Travere公司来说 ,似乎并不是什么坏事。
因为,Travere公司最近的精力应该都集中在Filspari上。Filspari是一款IgA肾病(IgAN)新药,是一种具有双重机制的内皮素/血管紧张素受体拮抗剂(DEARA)。
Filspari于2023年2月获得FDA的首次批准,用于减少有快速疾病进展风险的原发性IgA肾病(IgAN)成人患者的蛋白尿,这些患者普遍尿蛋白与肌酐比值(UPCR)≥1.5 g/g。
而在本月6号,Filspari获得了FDA的完全批准,用于减缓有疾病进展风险的原发性IgA肾病(IgAN)成人患者的肾功能下降。
Filspari被分析公司Clarivate列为2023年值得关注的潜在15款重磅疗法之一。但是此前Filspari的销售成绩并不十分亮眼。
Filspari在2023年的年销售额为2920万美元,低于Jefferies预测的3500万;Filspari自上市以来的总销售为7620万美元;尽管今年第二季度的销售额(2710万美元)相较于第一季度上涨了37%,但是Filspari的商业推广还有待加强。
因此,Pegtibatinase临床工作的暂停,能够使得Travere公司集中精力进行Filspari的市场推广。
此外,Pegtibatinase临床研究的延迟,Travere公司预计其2025年的研发费用将比今年减少3000万美元。这对于一直处于亏损的Travere公司来说,也能够松口气,等一波Filspari销售回血。
Travere公司报告其拥有现金3.254亿美元,可支持运营至2028年。
因此,尽管Pegtibatinase的3期临床研究暂停2年,分析师下调了Travere公司的股票目标价,但是还是保持了对该股的买入评级。
参考资料:
1.https://endpts.com/travere-halts-phase-3-inherited-disease-trial-due-to-manufacturing-scale-up-issue/